«Privar de glucosa a las células cancerígenas es como quitar el pie del acelerador»
Dominic D’Agostino
Introducción
El tema de hoy sigue el hilo del artículo sobre la perspectiva metabólica del cáncer. Vamos a exponer cómo desde este marco teórico la nutrición puede ayudar tanto a prevenir el cáncer, como a mejorar los resultados de los tratamientos convencionales.
La cetosis es un estado metabólico en el cual nuestro cuerpo deja de usar los carbohidratos como fuente de energía, priorizando el uso de grasas y cuerpos cetónicos. Podemos decir que básicamente es el estado fisiológico del ayuno, en el cual al no haber una ingesta de nutrientes, nuestro organismo pasa a utilizar las reservas de grasa como fuente primaria de energía.
La llamada dieta cetogénica consiste en simular mediante la ingesta de alimentos esta condición metabólica propia del ayuno, manteniendo un balance hormonal similar y permitiendo la opción de mantener el estado de cetosis más a largo plazo.
Impacto de la cetosis en el cáncer
Cuando ayunamos o mantenemos una dieta cetogénica, nuestras células sanas empiezan a consumir grasas y cuerpos cetónicos, en cambio, la inflexibilidad metabólica de las células cancerígenas les impide usar este combustible, lo que les ocasiona un estado de debilidad o incluso la muerte. En resumen, este estado permite a las células sanas nutrirse, mientras mata de hambre al tejido cancerígeno. En palabras del doctor Seyfried:
«Esta privación crónica del combustible que necesitan para crecer estresa y debilita las células cancerígenas y, si no las mata de primeras, las hace mucho más vulnerables a los tratamientos con radiación, quimioterapia y oxígeno hiperbárico.»
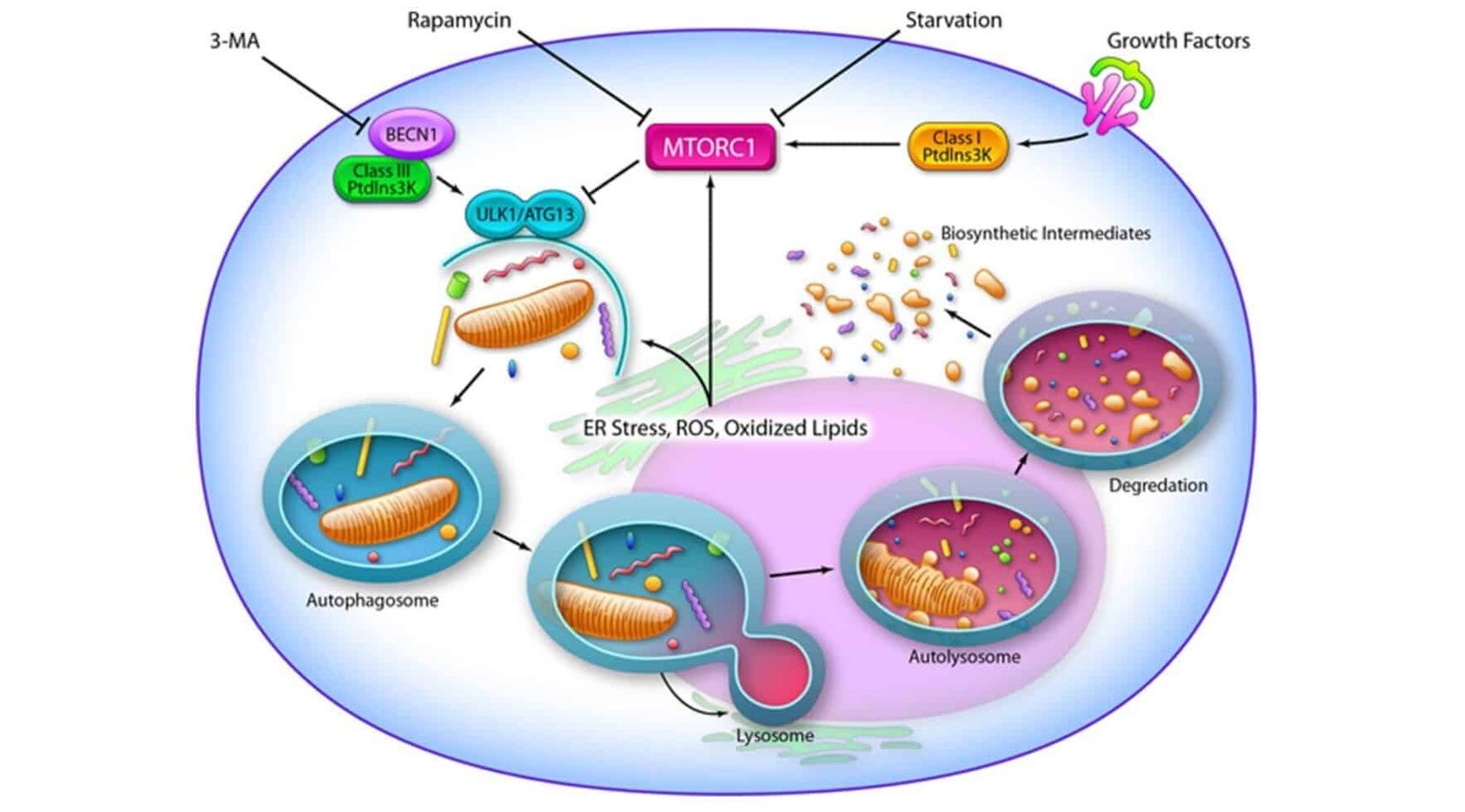
Por otro lado, nuestras células cuentan con un mecanismo de reciclaje interno llamado autofagia, importantísimo proceso para la vida que básicamente degrada las proteínas y demás sustancias dañadas o en desuso para poder aprovecharlas en otros usos. Este proceso es vital para la prevención del cáncer y otras enfermedades degenerativas, y está ampliamente estudiado que el ayuno, es decir, la cetosis, es el mayor estimulante para la autofagia. Citando al doctor Jason Fung:
«Este aumento en el glucagón estimula el proceso de la autofagia, de hecho, ayunar (elevar el glucagón) es el mayor estimulante de la autofagia. ¿Qué inhibe este proceso? Comer. La glucosa, la insulina (o la bajada del glucagón) y las proteínas inhiben este proceso de autolimpieza, y no hace falta una gran cantidad. Incluso una pequeña cantidad del aminoácido leucina puede parar la autofagia en seco.»
Parece ser según numerosos estudios que, al ayunar, este mecanismo de autofagia que no se activa en células cancerígenas protege a las células sanas ante los efectos nocivos de los agresivos tratamientos contra el cáncer, lo que minimiza los efectos secundarios del tratamiento.
Además, algunos estudios recientes sugieren que los cuerpos cetónicos inhiben en cierta medida el crecimiento tumoral por sí mismos, y otros estudios dicen que el factor de crecimiento IGF-1 se reduce con la restricción calórica o el ayuno, factor de peso para combatir el cáncer.
Conclusión
Como se puede observar, la cetosis abre numerosos frentes de combate contra el cáncer, tanto para combatir la enfermedad como a modo preventivo. Hay que señalar que una de las trabas con las que se encuentra este prometedor enfoque es lo lucrativa que resulta la oncología para el sector privado. El ayuno no es monetizable por las farmacéuticas, por lo que se hace muy difícil financiar este tipo de investigaciones.
Para terminar, quiero hacer referencia al trabajo de los investigadores Dominic D’Agostino y Seyfried que, como apuntan con el concepto “Press-Pulse”, la mejor opción contra el cáncer parece ser la estrategia de por un lado, generar estrés oxidativo mediante la cetosis y, por otro lado, atacar a las células cancerígenas con terapias convencionales.
«Creemos que el paradigma Press-Pulse es una estrategia terapéutica convincente y parsimoniosa para controlar eficazmente la gran mayoría de los cánceres malignos con la mínima toxicidad, ya que este enfoque se centrará en las principales vías energéticas responsables del crecimiento y la supervivencia de las células tumorales, al tiempo que mejora la eficiencia energética de las células y tejidos normales del cuerpo.»
Bibliografía y material de interés:
- Thomas N. Seyfried et al. “Press-pulse: a novel therapeutic strategy for the metabolic management of cancer”, en Nutrition & Metabolism. 2017. https://doi.org/10.1186/s12986-017-0178-2
- Eric C. Woolf et al. “Tumor Metabolism, the Ketogenic Diet and β-Hydroxybutyrate: Novel Approaches to Adjuvant Brain Tumor Therapy”, en Front. Mol. Neurosci. 2016. https://doi.org/10.3389/fnmol.2016.00122
- G. Bianchi et al. “Fasting induces anti-Warburg effect that increases respiration but reduces ATP-synthesis to promote apoptosis in colon cancer models.”, en Oncotarget. 2015. https://doi.org/10.18632/oncotarget.3688
- D.S. Straus, C.D. Takemoto. “Effect of fasting on insulin-like growth factor-I (IGF-I) and growth hormone receptor mRNA levels and IGF-I gene transcription in rat liver.”, en Molecular Endocrinology. Vol. 4, 91-100. 1990. https://doi.org/10.1210/mend-4-1-91
- C. Lee, V. D. Longo. “Fasting vs dietary restriction in cellular protection and cancer treatment: from model organisms to patients”, en Oncogene. 2011. http://dx.doi.org/doi:10.1038/onc.2011.91
- Otros artículos del blog sobre salud.
Artículo escrito por Pablo Vázquez Arillo, Junio 2018.